Bonjour,
Le microbiote, un territoire plein de promesses et de mystères
La recherche dans le domaine est foisonnante, révélant peu à peu le rôle majeur de notre flore intestinale sur notre santé. Le microbiote – ou plutôt les microbiotes – constitue un univers pluriel, aussi bien par ses localisations que par ses multiples variations individuelles. Les liens entre intestin et cerveau sont de plus en plus évidents, mais restent à éclaircir. Les espoirs thérapeutiques sont nombreux, que ce soit pour l’alzheimer, l’ostéoporose ou l’infection à «Clostridium difficile».
Elodie Lavigne

«Escherichia coli»: Bactérie la plus utilisée en laboratoire, elle est capable de synthétiser la vitamine K. La plupart des souches sont inoffensives, mais certaines peuvent causer des infections sévères.
STEVE GSCHMEISSNERDécouvert grâce aux techniques de séquençage génétique dans les années 2000, le microbiote intestinal, et les milliards d’organismes qui le composent, joue un rôle déterminant sur notre santé. La composition de cet univers jusqu’ici inconnu – ou presque – pourrait expliquer le développement de nombreuses maladies, tandis que sa manipulation pourrait offrir de nouvelles options thérapeutiques. L’influence du microbiote intestinal sur notre organisme, en particulier sur notre cerveau, apparaît en effet majeure. Cette réputation de rôle clé dans la santé procède de premières études scientifiques comparant le comportement de souris nées artificiellement sans microbiote avec celui d’animaux nés dans des conditions normales. Les premières se révèlent plus chétives et plus fragiles. Elles sont davantage sujettes à la maladie, au stress et à des troubles du développement. Néanmoins, les effets de l’absence de microbiote sur le comportement restent peu clairs.
1. Qu’est-ce que le microbiote?
Le terme «microbiote» désigne l’ensemble des micro-organismes – bactéries, virus, champignons et parasites – vivant au sein d’un organisme sans pour autant lui nuire. L’essor de la biologie moléculaire et le développement du séquençage permettent désormais d’étudier de plus près les nombreuses espèces composant le microbiote intestinal, situé dans l’intestin grêle et le côlon. «Les chercheurs s’intéressent en particulier à sa composition, aux interactions avec l’hôte, aux relations que ces micro-organismes entretiennent entre eux et à leurs effets sur notre santé. Le microbiote intestinal étant un acteur majeur du maintien de celle-ci, il est logique qu’il puisse être impliqué dans le développement de pathologies lorsque sa composition ou ses fonctions sont altérées», déclare Sophie Restellini, médecin-cheffe de clinique au service de gastro-entérologie et hépatologie des Hôpitaux universitaires de Genève (HUG), dans un ouvrage à paraître*. Le microbiote intestinal est le plus connu et le plus étudié de tous les microbiotes (lire ci-après). La nature de ce dernier varie selon les individus et leur est propre, un peu à la manière de notre ADN.

«Coprococcus»: Appartenant aux cocci, elle pourrait protéger contre le cancer de la prostate, mais elle a aussi été systématiquement retrouvée dans le microbiote de personnes souffrant de dépression.
Dr. V.R. Dowell/CDC
«Coprococcus»: Appartenant aux cocci, elle pourrait protéger contre le cancer de la prostate, mais elle a aussi été systématiquement retrouvée dans le microbiote de personnes souffrant de dépression.
Dr. V.R. Dowell/CDC2. Le ventre, mais pas que
Présentes en nombre dans notre ventre, les bactéries colonisent également d’autres parties de notre corps. La peau, la bouche, le vagin et même les poumons – que l’on croyait stériles – abritent une flore microbienne, propre à chaque site anatomique. La découverte d’un microbiote pulmonaire, en l’absence même de signes infectieux, a été une vraie surprise, qui s’explique en partie par la difficulté de cultiver ces germes en dehors de leur milieu. Il semble que les bactéries que l’on trouve dans la bouche et dans la gorge influencent sa composition. De même, l’existence d’une maladie respiratoire (BPCO, fibrose pulmonaire, etc.) peut le modifier, à moins que ce ne soit l’inverse, autrement dit que ces maladies soient en partie causées ou favorisées par la composition du microbiote… Certains microbiotes pourraient par exemple nous protéger d’infections virales.
3. Le temps de la colonisation
Le nouveau-né passe d’un milieu stérile, dans le ventre de sa mère, à un monde peuplé de microbes dès sa venue au monde. Son microbiote se constitue rapidement et se modifie encore durant les premières années de vie. Cette période est donc déterminante. Tout commence à l’accouchement. Un bébé qui naît par voie basse est surtout colonisé par les germes de la flore vaginale de sa mère, tandis que le bébé né par césarienne est en contact avec les germes de sa flore cutanée. Une différence qui tend néanmoins à s’estomper autour des 6 mois de vie. D’autres facteurs entrent en jeu dans la nature du microbiote intestinal. L’allaitement maternel favorise par exemple la concentration de certaines bactéries au détriment d’autres. Mais aussi, plus globalement, l’environnement (ville, campagne, hygiène) dans lequel l’enfant grandit, la prise de médicaments (antibiotiques principalement) au cours des premières années, l’alimentation tout particulièrement ainsi que le capital génétique dans une moindre mesure. La flore microbienne se diversifie peu à peu jusqu’à l’âge de 4 ans, après quoi elle tend à se stabiliser. Toutefois, même à l’âge adulte, nous gardons un certain pouvoir sur notre microbiote, puisque ce que nous mangeons influence sa composition. Pour préserver sa diversité, il est important de miser sur une alimentation variée, équilibrée et surtout non transformée.
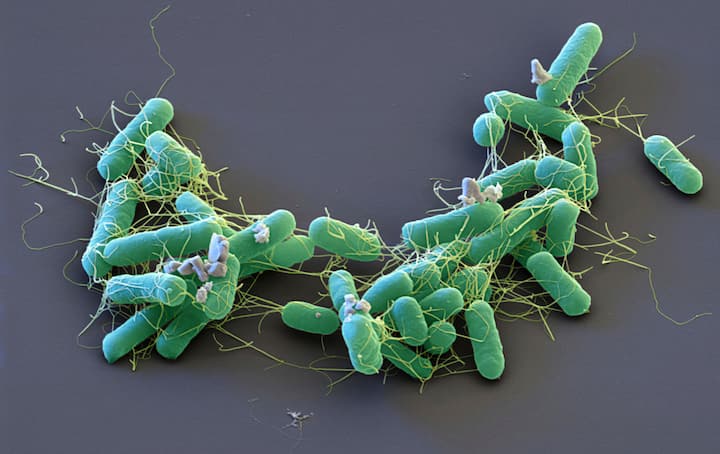
«Salmonella enterica»: Les bactéries de cette famille sont à l’origine de très nombreuses infections alimentaires avec diarrhée. Elles sont surtout présentes chez les volailles.
EYE OF SCIENCE/SCIENCE PHOTO LIBRARY
«Salmonella enterica»: Les bactéries de cette famille sont à l’origine de très nombreuses infections alimentaires avec diarrhée. Elles sont surtout présentes chez les volailles.
EYE OF SCIENCE/SCIENCE PHOTO LIBRARY4. De multiples fonctions
Le tube digestif étant en constante communication avec le monde extérieur, son microbiote constitue en premier lieu une barrière contre les éléments pathogènes. Il occupe le terrain, empêchant ainsi la colonisation par d’autres germes. Ensuite, il assure un rôle central dans la digestion, puisqu’il permet l’assimilation des fibres, des lipides, des glucides, etc. ainsi que la métabolisation des aliments: «Les bactéries intestinales produisent de l’énergie, des vitamines, ainsi que de multiples substances particulières – les métabolites – qui ont des effets sur d’autres organes tels que le cœur, les reins, le cerveau, etc., avec lesquels elles communiquent», explique Vladimir Lazarevic, chercheur au laboratoire de génomique à la Faculté de médecine de l’Université de Genève. C’est précisément ce qui le rend fascinant: le microbiote est un véritable organe en soi, dont les fonctions dépassent la seule sphère intestinale. Il joue notamment un rôle essentiel dans les mécanismes de défense immunitaire. Vous l’ignoriez? L’intestin grêle est le premier réservoir de cellules immunitaires de notre organisme!
5. Un rôle dans l’apparition de maladies
Si on ignore encore à quoi ressemble le microbiote idéal, on observe toutefois des différences significatives entre la flore des individus en bonne santé et celle des malades. Ainsi, l’apparition de certaines maladies pourrait être liée à un déséquilibre (ou dysbiose) de la flore intestinale, avec une surreprésentation de certaines espèces au détriment d’autres. Ce mécanisme semble impliqué aussi bien dans des maladies inflammatoires digestives (colite ulcéreuse, par exemple), cardiovasculaires, métaboliques (obésité), neurodégénératives (maladie de Parkinson, d’Alzheimer), respiratoires (asthme) que dans des troubles psychiques (anxiété, dépression) ou du développement (autisme). Des études menées chez les souris ont d’ailleurs montré qu’un stress important (séparation d’avec la mère) au début de la vie entraîne une modification du microbiote intestinal (appauvrissement), conduisant à une plus grande vulnérabilité au stress et à l’anxiété à l’âge adulte. Une autre étude a montré des constantes dans le microbiote de personnes souffrant de dépression. L’axe intestin-cerveau fait d’ailleurs l’objet de nombreuses recherches. «Les mécanismes exacts expliquant les effets d’une dysbiose sur le cerveau ne sont pas encore clairement établis, mais il se pourrait que le microbiote module ces interactions par différentes voies, endocriniennes, immunitaires et neuronales», explique le Pr Jacques Schrenzel, responsable du laboratoire de bactériologie des HUG. Mais restons prudents, car il s’agit le plus souvent d’associations et non de lien de causalité entre dysbioses et maladies.

«Bifidobacterium bifidum»: Appelées bifidus à cause de leur forme en Y, ces bactéries survivent au processus digestif, ce qui leur permet d’entrer en compétition avec les pathogènes pour qu’ils ne créent pas d’infection.
SCIMAT/SCIENCE PHOTO LIBRARY
«Bifidobacterium bifidum»: Appelées bifidus à cause de leur forme en Y, ces bactéries survivent au processus digestif, ce qui leur permet d’entrer en compétition avec les pathogènes pour qu’ils ne créent pas d’infection.
SCIMAT/SCIENCE PHOTO LIBRARY6. Des espoirs thérapeutiques
La meilleure compréhension du rôle du microbiote intestinal fait naître de nouveaux espoirs diagnostiques et thérapeutiques. En corrigeant les déséquilibres de la flore intestinale grâce à des techniques comme la transplantation fécale ou l’administration de probiotiques et de prébiotiques**, les patients pourraient retrouver un état antérieur à la maladie. Des études concluantes existent chez la souris. Les applications restent toutefois très restreintes chez l’homme (lire ci-après). L’application rationnelle des probiotiques ou des prébiotiques ne fait que débuter.
* «J’ai envie de comprendre pourquoi j’ai mal au ventre», Sophie Restellini, Michel Maillard, Sophie Davaris, Editions Planète Santé, 2021.
** Les probiotiques sont des micro-organismes vivants (bactéries, levures…) exerçant un effet bénéfique sur l’organisme qui les ingère. Le yaourt est par exemple un aliment probiotique. Les prébiotiques sont des substances non digestibles servant de substrat à la flore du côlon.
*Rédigé en collaboration avec Planète santé
Trois pistes thérapeutiques porteuses d’espoir
• Une nouvelle arme contre l’ostéoporose
Avec l’augmentation de l’âge de la population, l’ostéoporose, cette maladie qui rend nos os moins solides et donc plus vulnérables aux fractures, ne cesse de gagner en importance. Dans une étude parue en septembre dernier dans Cell Metabolism, le professeur Mirko Trajkovski, de l’Université de Genève (Unige), et son équipe ont pu montrer que, en influençant la composition du microbiote, la chaleur permettait d’améliorer la densité osseuse. Concrètement, les chercheurs ont observé que des polyamines, des molécules qui sont impliquées dans la solidité des os, étaient dégradées moins rapidement sous l’effet de la chaleur. Les polyamines modifient l’activité des ostéoblastes (les cellules qui construisent les os) et réduisent le nombre des ostéoclastes (les cellules qui dégradent les os). «Avec l’âge, et la ménopause chez la femme, le délicat équilibre entre ostéoblastes et ostéoclastes est perturbé, ce qui entraîne la fragilisation des os, explique Claire Chevalier, première autrice de l’étude. En agissant sur les polyamines qui sont partiellement régulées par le microbiote, la chaleur peut maintenir l’équilibre entre ces deux groupes cellulaires.» Maintenant qu’ils ont compris ce mécanisme, les chercheurs espèrent pouvoir créer des cocktails de bactéries, des probiotiques, pour les donner aux personnes dont la santé osseuse n’est pas optimale afin de modifier leur microbiote et retarder ainsi l’apparition de l’ostéoporose. Plus besoin, en somme, de se rendre dans les pays chauds pour bénéficier des effets de la chaleur sur la solidité osseuse. Ils se retrouvent directement dans l’estomac.
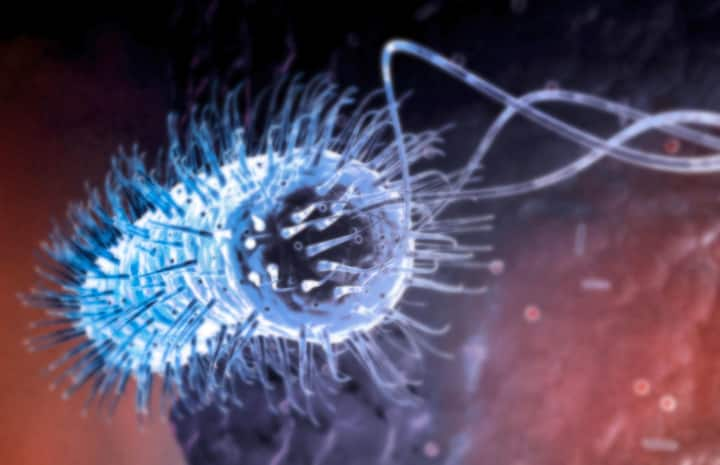
«Helicobacter pylori»: Très résistante, elle arrive à survivre dans l’acidité de l’estomac où elle est capable de transformer localement l’urée en ammoniac. Elle est à l’origine d’ulcères d’estomac et même de cancers.
MEDICAL RF.COM
«Helicobacter pylori»: Très résistante, elle arrive à survivre dans l’acidité de l’estomac où elle est capable de transformer localement l’urée en ammoniac. Elle est à l’origine d’ulcères d’estomac et même de cancers.
MEDICAL RF.COM• Prévenir la maladie d’Alzheimer
Incurable, la maladie d’Alzheimer est la cause de démence la plus fréquente diagnostiquée dans les pays développés. Elle touche près de 1 million de personnes en Europe, sans compter l’entourage des malades. Le professeur Giovanni Frisoni, directeur du Centre de la mémoire des Hôpitaux universitaires de Genève, travaille depuis de nombreuses années sur l’influence du microbiote sur les maladies dégénératives. En novembre dernier, dans le Journal of Alzheimer’s Disease, l’équipe dirigée par le neurologue de l’Université de Genève et des collègues italiens ont pu confirmer qu’une corrélation existait entre un déséquilibre du microbiote intestinal et le développement dans le cerveau humain des plaques amyloïdes qui sont responsables des troubles neurodégénératifs caractéristiques de la maladie d’Alzheimer. Le procédé? Des protéines produites par certaines bactéries intestinales, identifiées dans le sang des malades, pourraient modifier l’interaction entre le système immunitaire et le système nerveux et déclencher la maladie. Les chercheurs espèrent maintenant pouvoir identifier les bactéries impliquées dans le processus pour produire des molécules, des prébiotiques, qui pourraient nourrir et favoriser le développement de bonnes bactéries dans l’intestin. Cette découverte ouvre ainsi de nouvelles pistes pour la prévention de la maladie d’Alzheimer. Pour Giovanni Frisoni, «il ne faut cependant pas se réjouir trop vite». D’abord parce que identifier les bonnes souches de bactéries ne va pas être évident. Mais aussi parce qu’il faudra diagnostiquer les malades très tôt, ce qui est, pour la maladie d’Alzheimer, extrêmement difficile.

«Clostridium difficile»: Elle est le principal agent des diarrhées provoquées par les antibiotiques et par les maladies nosocomiales, soit celles contractées dans les établissements de santé.
Science Photo Library
«Clostridium difficile»: Elle est le principal agent des diarrhées provoquées par les antibiotiques et par les maladies nosocomiales, soit celles contractées dans les établissements de santé.
Science Photo Library• Transplantation fécale pour «Clostridium difficile»
Véritable problème de santé publique et très pénible pour les malades, l’infection à Clostridium difficile représente 20 à 30% des diarrhées dues aux antibiotiques et est la cause principale des diarrhées nosocomiales. Problème supplémentaire: les récidives sont fréquentes. Comme traitement, on a recours à des antibiotiques. Dans les formes graves et qui ne répondent pas à ces traitements, on utilise de plus en plus la transplantation fécale. Guérir en incorporant des selles de quelqu’un d’autre, vous avez bien lu! Plutôt que d’essayer de détruire directement les bactéries infectieuses (le Clostridium) en utilisant des antibiotiques qui vont aussi détruire d’autres bactéries, on administre une préparation de matière fécale issue d’un sujet sain pour restaurer l’altération du microbiote intestinal du patient atteint. La transplantation des selles peut se faire par sonde, par instillation des selles directement dans le côlon pendant une coloscopie ou encore par capsules. L’infection à Clostridium difficile récidivante est la seule indication reconnue de la transplantation fécale en pratique clinique.
Toutefois, cette technique suscite un fort intérêt pour traiter la colite ulcéreuse, avec de premiers résultats encourageants, mais aussi quantité d’autres maladies, comme le syndrome de l’intestin irritable, l’autisme ou le diabète. «De nombreuses études montrent son efficacité pour traiter les infections récidivantes à Clostridium difficile, avec des taux de succès de l’ordre de 80 à 90%», explique Sophie Restellini, gastro-entérologue aux HUG et spécialiste des maladies inflammatoires de l’intestin. Problème: les effets secondaires potentiels. «Lorsqu’on transplante des selles, le receveur reçoit de très nombreux gènes de la flore intestinale du donneur, ce qui pourrait avoir des conséquences néfastes sur sa santé. Pour le moment, nous ne maîtrisons pas ces éventuels effets secondaires, c’est pourquoi, en dehors de l’infection récidivante à Clostridium difficile, la transplantation fécale ne doit être pratiquée que dans le cadre de la recherche.»