Bonjour,
Immunothérapie: dix stars mondiales sont en Suisse romande
Aider notre système immunitaire à combattre lui-même les cellules cancéreuses, tel est le principe de l’immunothérapie. Si l’idée semble simple aujourd’hui, elle est pourtant révolutionnaire et vient élargir l’artillerie thérapeutique pour traiter les cancers. Le bassin lémanique concentre les plus grands spécialistes de la question. Ils nous en parlent.
Clémentine Fitaire

Le Pr Pierre-Yves Dietrich, chef du département d’oncologie des HUG: «L’immunothérapie détient cette capacité à s’adapter aux changements incessants de la tumeur qu’elle vise.»
© Fred Merz | lundi13«Nous avons assisté à des progrès fantastiques»
Pr Pierre-Yves Dietrich, chef du département d’oncologie des Hôpitaux universitaires de Genève (HUG), professeur à la Faculté de médecine de l’Université de Genève (Unige), codirecteur du Swiss Cancer Center Léman
- Il y a une trentaine d’années, lorsque le Pr Jean-Charles Cerottini, alors directeur de l’Institut Ludwig Lausanne, a ouvert la voie de l’immunothérapie en Suisse, vous pressentiez vous aussi l’énorme potentiel de cette technique. Pourquoi?
- Pr Pierre-Yves Dietrich: Jean-Charles Cerottini a joué un rôle de pionnier en Suisse. Il y a trente ans, nous étions à des années-lumière des connaissances dont nous disposons aujourd’hui sur le système immunitaire. Alors, imaginer qu’il pouvait être l’une des clés pour combattre le cancer était illusoire et, pour beaucoup, complètement farfelu. Mais des travaux, sur l’allogreffe* de moelle osseuse par exemple, interpellaient: assez rapidement en effet, il est devenu évident que les patients guéris après une allogreffe l’étaient grâce à un système immunitaire tout neuf, celui du donneur, transplanté avec la moelle. Ce constat a croisé une intuition profonde: si le système immunitaire d’un donneur est capable de détruire des cellules cancéreuses, pourquoi cela ne serait-il pas possible avec le système immunitaire du patient lui-même ?
- Trente ans plus tard, les faits vous ont donné raison…
- Au fil du temps, les initiatives et convictions individuelles de chercheurs ont donné lieu à des résultats concrets. L’engouement et les soutiens sont devenus exponentiels. En parallèle, nous avons assisté à des progrès fantastiques dans des domaines aussi variés que la biotechnologie, l’ingénierie, l’informatique ou encore l’imagerie. C’est bien la convergence de ces progrès qui a rendu possibles des développements impensables il y a quelques années seulement.
- Quels obstacles demeurent?
- Il est crucial de parler des outils mis en place pour contrer le cancer, mais nous devons aussi revenir avec humilité à la complexité de la maladie cancéreuse. Il n’existe pas un seul cancer, mais une infinité de situations singulières. Sans compter que les tumeurs sont changeantes, capables de s’adapter et de déjouer les attaques. Or l’immunothérapie détient cette capacité à s’adapter aux changements incessants de la tumeur qu’elle vise. C’est probablement ce qui en fait sa plus grande force.
* Allogreffe: par opposition à l’autogreffe, l’allogreffe concerne une greffe pour laquelle donneur et receveur sont deux personnes différentes.
«Les cellules nouvelle génération sont prometteuses»
Pr Denis Migliorini, médecin hospitalo-universitaire responsable de la consultation des tumeurs cérébrales aux HUG, titulaire de la chaire ISREC d’immunologie des tumeurs cérébrales

Le Pr Denis Migliorini: «On observe 90% de réponse complète chez certains patients avec tumeurs réfractaires pour lesquels tous les traitements standard avaient échoué.»
Julie de Tribolet
Le Pr Denis Migliorini: «On observe 90% de réponse complète chez certains patients avec tumeurs réfractaires pour lesquels tous les traitements standard avaient échoué.»
Julie de Tribolet- Comment agissent les CAR-T cells*?
- Pr Denis Migliorini: Avec l’immunothérapie, l’idée n’est plus seulement de renforcer les lymphocytes T, mais de les doter de récepteurs «chimériques» (artificiels) qui les rendent capables de reconnaître une cible (appelée antigène) pour détruire la cellule tumorale. Cette technologie a été approuvée par les instances régulatrices internationales et Swissmedic dans le traitement de maladies du sang comme les lymphomes B de l’adulte ou les leucémies aiguës pédiatriques réfractaires. On observe 90% de réponse complète chez des patients avec tumeurs réfractaires pour lesquels tous les traitements standard avaient échoué. Et la rémission s’avère durable, car les CAR-T cells ont la capacité de circuler dans le sang et d’exercer une veille immunitaire durant plusieurs années dans certains cas.
- Comment parvient-on à transformer un lymphocyte T en CAR-T cell?
- Les lymphocytes T du patient sont prélevés, modifiés en laboratoire par le biais d’un vecteur viral pour exprimer ce récepteur chimérique. Une expansion est réalisée in vitro jusqu’à obtenir plusieurs centaines de millions de cellules que l’on réinjecte au patient. C’est un travail qui nécessite une grande expertise. Les premiers patients aux HUG ont récemment bénéficié de ce traitement, et ils devraient être de plus en plus nombreux au vu des résultats encourageants dans les maladies du sang.
- Quelles sont les promesses d’avenir de cette technologie?
- Nous en sommes encore aux prémices. Le challenge est maintenant d’adapter ces CAR-T cells aux tumeurs solides (tumeurs cérébrales, pancréatiques, carcinomes ovariens, sarcomes…), plus hétérogènes et complexes que les tumeurs du sang. Pour l’instant, les CAR-T cells sont dotées d’un seul récepteur. Les possibilités de l’ingénierie cellulaire sont virtuellement sans limites. On pourrait envisager de rendre ces CAR-T cells multispécifiques afin d’agir contre les différents marqueurs présents dans les cellules tumorales solides, mais aussi les rendre insensibles aux molécules immunosuppressives produites par les tumeurs.
* CAR-T cells (Chimeric Antigen Receptor T cells ou cellules T à récepteur antigénique chimérique): lymphocytes T prélevés chez le patient, puis génétiquement modifiés pour cibler les cellules cancéreuses et ensuite réinjectés par perfusion.
>> Lire aussi: Cancer: distinguons le vrai du faux!
«Une révolution pour le cancer du poumon»
Pre Solange Peters, cheffe du service d’oncologie médicale, département d’oncologie, Centre hospitalier universitaire vaudois (CHUV-Unil), présidente de la Société européenne d’oncologie médicale (ESMO)

La Pre Solange Peters: «Aujourd’hui, trois ans après un diagnostic de cancer des poumons, plus d’un tiers des patients sont toujours en vie.»
Julie de Tribolet
La Pre Solange Peters: «Aujourd’hui, trois ans après un diagnostic de cancer des poumons, plus d’un tiers des patients sont toujours en vie.»
Julie de Tribolet- Quel regard portez-vous sur les progrès engendrés par l’immunothérapie, en particulier pour l’un des cancers qui, jusqu’ici, en ont le plus profité et dont vous êtes spécialiste: le cancer du poumon?
- Pre Solange Peters: Le cancer du poumon est en effet l’un des premiers pour lesquels l’immunothérapie a changé le devenir des patients. L’explication est d’abord physiologique: le cancer dit du fumeur (environ 90% des cancers du poumon en Suisse) se caractérise par des cellules cancéreuses particulièrement anormales en raison des mutations induites par les substances toxiques de la cigarette. De ce fait, à l’instar des mélanomes (et les dommages dus aux UV), ces tumeurs sont facilement repérées par le système immunitaire et constituent donc de bonnes «candidates» pour l’immunothérapie. Et puis, il y a la situation de départ: jusqu’à récemment, le cancer du poumon était grevé de l’un des plus mauvais pronostics puisque l’espérance de vie des patients avec maladies avancées dépassait rarement une année. Aujourd’hui, trois ans après un diagnostic, plus d’un tiers des patients sont toujours en vie. Nous devons bien sûr faire bien mieux encore.
- Quels sont les axes de recherche?
- Ils sont nombreux, mais deux d’entre eux sont déterminants. Le premier est d’intensifier l’action de l’immunothérapie, notamment en la combinant à d’autres thérapies (la radiothérapie par exemple). Le deuxième se joue au niveau de l’identification, via des biomarqueurs*, des patients pour lesquels l’immunothérapie peut être le plus efficace. Apporter le bon traitement à la bonne personne constitue un enjeu crucial.
- L’immunothérapie a donc bel et bien fait naître un espoir nouveau…
- Absolument. Parler d’espoir ne veut pas dire que tout va bien aller pour chacun, mais qu’un plan thérapeutique est possible. C’est ce qu’a généré l’immunothérapie pour de nombreux patients. Il reste beaucoup à faire, mais nous avons des atouts puissants. Parmi eux: l’excellence du système de santé suisse, qui permet un accès réel et rapide à ces thérapies encore très coûteuses aux personnes en ayant besoin. Nous devons veiller à protéger son équité à l’avenir.
* Biomarqueur: caractéristique biologique pouvant servir d’indicateur d’une fonction ou d’une pathologie.
«Un bond impressionnant dans le traitement du mélanome»
Pr Olivier Michielin, médecin-chef du Centre d’oncologie de précision et responsable de la consultation spécialisée du mélanome, département d’oncologie CHUV-Unil
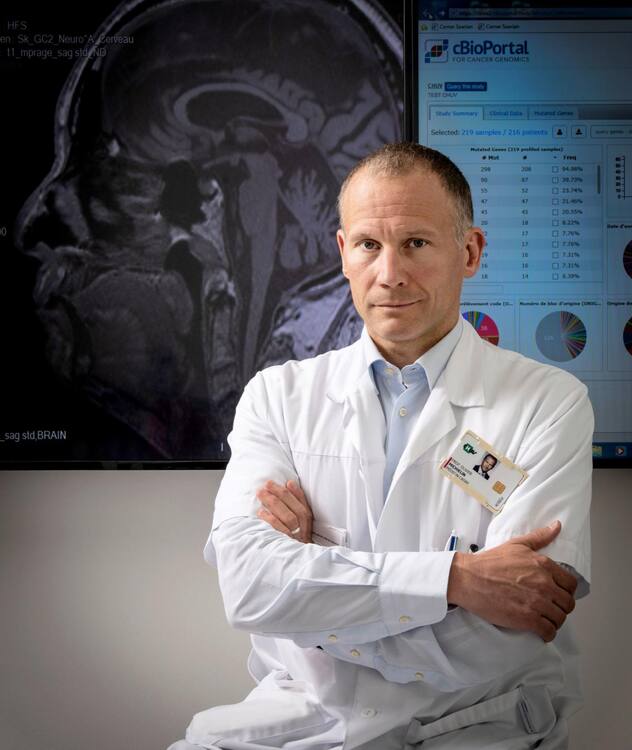
Le Pr Olivier Michielin: «L’étape suivante est d’aller vers l’immuno-oncologie de précision.»
Darrin Vanselow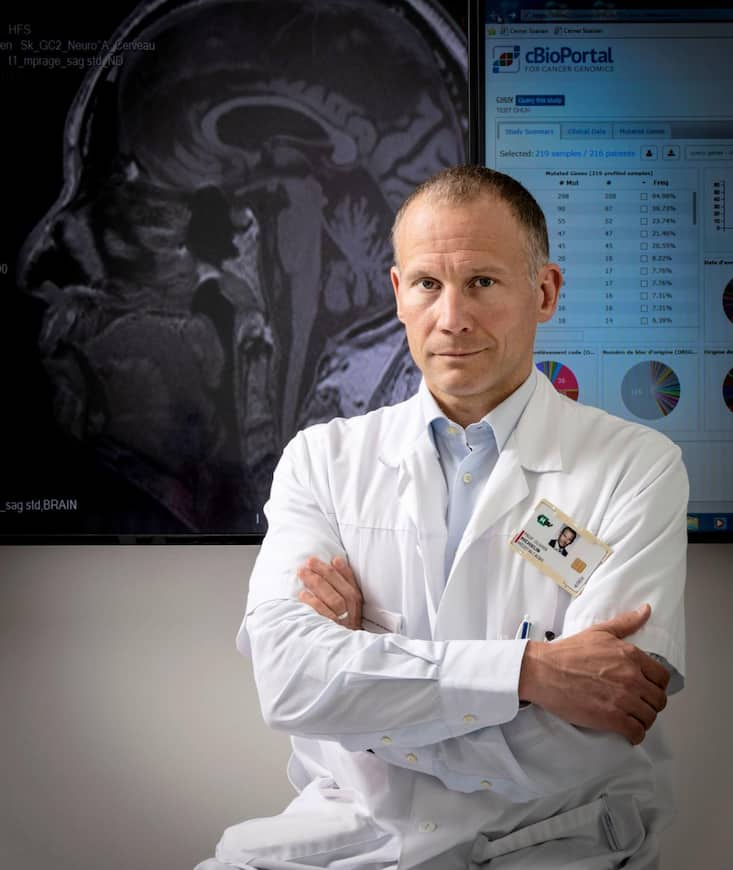
Le Pr Olivier Michielin: «L’étape suivante est d’aller vers l’immuno-oncologie de précision.»
Darrin Vanselow- Qu’a apporté la recherche sur le mélanome?
- Pr Olivier Michielin: Le mélanome est historiquement un type de tumeur qui a été étudié sous l’angle de l’immunothérapie, notamment avec les inhibiteurs de points de contrôle* (ou checkpoints), qui sont désormais parmi les médicaments les plus utilisés en immunothérapie conventionnelle. Cela a permis de faire un bond impressionnant dans le traitement de cette maladie. Il y a quelques années, la survie chez les patients en phase métastasique était limitée à quelques mois. Aujourd’hui, après cinq, six ans, la maladie est sous contrôle grâce à l’immunothérapie pour plus de 50% d’entre eux.
- Pourquoi le mélanome est-il particulièrement sensible à l’immunothérapie?
- L’une des hypothèses concerne l’immunogénicité de la tumeur, c’est-à-dire la capacité du système immunitaire à la reconnaître. On sait que plus les cellules cancéreuses possèdent de mutations, plus le système immunitaire parvient à les distinguer des cellules saines. Or les cellules du mélanome comportent beaucoup de mutations. Cela est la conséquence de l’action des rayons UV sur notre peau. C’est assez paradoxal: ces mutations sont à l’origine du cancer, mais leur présence en grand nombre permet en contrepartie une meilleure efficacité de l’immunothérapie.
- Tous les patients pourraient-ils en bénéficier?
- Mélanomes et systèmes immunitaires ne sont pas identiques d’un individu à l’autre, ce qui rend tout cela extrêmement complexe. Si, pour 50% des patients, la maladie reste sous contrôle sur le long terme, pour l’autre moitié, l’immunothérapie ne fonctionne pas. L’étape suivante est donc d’aller vers de l’immuno-oncologie de précision en parvenant à cibler des inhibiteurs de checkpoints particuliers selon les patients. Nous y travaillons notamment dans le cadre d’un projet pilote avec le réseau national de santé personnalisée (Swiss Personalized Health Network).
* Inhibiteurs de points de contrôle ou inhibiteurs de checkpoints immunitaires: anticorps qui bloquent les protéines spécifiques des points de contrôle à la surface de la cellule cancéreuse, permettant ainsi aux cellules immunitaires de les attaquer et les détruire.
«Combiner radiothérapie et immunothérapie, une arme de plus»
Pr Jean Bourhis, responsable du service de radio-oncologie au CHUV

Le Pr Jean Bourhis: «Pour faire face à la complexité des cancers, la complémentarité des traitements a beaucoup de sens.»
Dom Smaz
Le Pr Jean Bourhis: «Pour faire face à la complexité des cancers, la complémentarité des traitements a beaucoup de sens.»
Dom Smaz- Si la combinaison entre les traitements oncologiques semble déterminante dans la prise en charge du cancer, l’idée d’allier immunothérapie et radiothérapie apparaît particulièrement novatrice. Quel est son principe?
- Pr Jean Bourhis: Elle repose sur l’hypothèse selon laquelle la radiothérapie à des doses adaptées, moins intenses que dans la pratique habituelle, pourrait aider l’action de l’immunothérapie en rendant la tumeur plus inflammatoire. Elle deviendrait alors plus facilement détectable par le système immunitaire et ainsi plus sensible à l’immunothérapie. Plusieurs études dans ce sens sont en cours au CHUV.
- Cette stratégie pourrait-elle remplacer les pratiques de radiothérapie actuelle?
- Elle pourrait plutôt constituer une arme de plus, mieux adaptée à certains cas. Aujourd’hui, la radiothérapie est utilisée dans 60% des cancers, en particulier ceux du sein, de la prostate, du rectum, de la sphère ORL. Ces nouveaux développements pourraient ouvrir sur de nouvelles indications.
- Quelles sont les pistes clés?
- Pour faire face à la complexité des cancers, la complémentarité des traitements – chirurgie, chimiothérapie, etc. – a beaucoup de sens, c’est certain. Mais chaque technique se développe elle-même. En plus de cent ans d’existence, la radiothérapie a fait des progrès considérables, aboutissant à des interventions de plus en plus précises et efficaces. Et une nouvelle technique se profile: la «radiothérapie flash». Celle-ci permet une action «éclair», à la fois particulièrement puissante et capable d’épargner les tissus sains. Ce nouveau procédé pourrait lui aussi contribuer à faire évoluer la prise en charge du cancer dans la décennie à venir.
>> Lire aussi: Cellules souches: «Le don de mon frère m’a sauvé la vie»
«Thérapies expérimentales: une perspective concrète et rapide»
Pre Lana Kandalaft, cheffe de service du Centre de thérapies expérimentales, département d’oncologie, CHUV

La Pre Lana Kandalaft: «Contrairement aux médicaments classiques, les thérapies cellulaires dans l’immunothérapie peuvent s’ajuster sur des délais beaucoup plus courts.»
Julie de Tribolet
La Pre Lana Kandalaft: «Contrairement aux médicaments classiques, les thérapies cellulaires dans l’immunothérapie peuvent s’ajuster sur des délais beaucoup plus courts.»
Julie de Tribolet- Vous êtes à l’origine du Centre de thérapies expérimentales (CTE) du CHUV, qui fête ses 6 ans d’existence cette année. Quelle place y occupe l’immunothérapie?
- Pre Lana Kandalaft: Elle est centrale. En tant que plateforme hospitalière de recherche, le CTE fait un pont permanent entre, d’une part, le laboratoire et les thérapies cellulaires personnalisées qui s’y développent et, d’autre part, les patients eux-mêmes. Notre priorité est de miser sur ces interactions permanentes pour optimiser les recherches dans le domaine de l’immunothérapie et qu’elles se muent en perspective thérapeutique concrète et rapide pour les patients.
- Ce facteur temps constitue-t-il l’un des leviers clés avec l’immunothérapie?
- C’est certain. Contrairement aux médicaments classiques nécessitant des étapes de tests et de productions en partie incompressibles aboutissant à des mises sur le marché au bout de dix ou vingt ans parfois, les thérapies cellulaires impliquées dans l’immunothérapie peuvent s’ajuster dans des délais beaucoup plus courts. Au sein du CTE, nous mettons en place des études cliniques pour des patients au profil très ciblé. Elles se concentrent sur deux priorités: l’innocuité et l’efficacité du traitement. Une fois les modalités validées par Swissmedic, nous lançons les tests thérapeutiques et nous poursuivons dans la foulée les investigations selon les résultats obtenus.
- Quels sont les défis prioritaires du CTE?
- Nous souhaitons intensifier encore notre activité pour agir sur deux plans: tester davantage de produits thérapeutiques – certains de ceux qui sont élaborés au sein des laboratoires du CHUV semblent particulièrement prometteurs – et étendre nos études à davantage de patients et à des stades plus précoces de la maladie.
>> Lire aussi: «Une intervention médicale sur cinq est inutile»
«Leucémies: de nouveaux moyens pour amplifier la réponse immunitaire»
Pr Jérôme Tamburini, médecin du département de médecine interne des spécialités, Centre de recherche translationnelle en onco-hématologie, Faculté de médecine Unige, département d’oncologie, HUG

Le Pr Jérôme Tamburini: «Nos travaux visent notamment à découvrir des nouvelles cibles immunitaires.»
Julie de Tribolet
Le Pr Jérôme Tamburini: «Nos travaux visent notamment à découvrir des nouvelles cibles immunitaires.»
Julie de Tribolet- Quelle place tient aujourd’hui l’immunothérapie dans le traitement des lymphomes?
- Pr Jérôme Tamburini: L’immunothérapie est utilisée dans les cas de lymphomes depuis les années 2000. Pour traiter les lymphomes non hodgkiniens, on utilise aujourd’hui majoritairement des anticorps anti-CD20 généralement couplés à une polychimiothérapie. Plus récemment, le CD19 – un marqueur spécifique des lymphocytes B – a émergé comme une cible attractive via trois stratégies différentes: les anticorps «classiques», les anticorps bispécifiques* ou les CAR-T cells, une technologie révolutionnaire qui représente une avancée majeure dans la prise en charge des lymphomes B. Pour le lymphome de Hodgkin, la découverte de l’expression du marqueur CD30 par les cellules tumorales a permis le développement du brentuximab, un anticorps anti-CD30 couplé à une molécule de chimiothérapie qui a permis d’améliorer le pronostic des patients en rechute. Plus récemment, l’immunothérapie par inhibiteurs de points de contrôle a également démontré d’excellents résultats dans cette situation.
- Qu’en est-il pour les leucémies?
- Les premières indications ont porté sur un anticorps bispécifique anti-CD19, le blinatumomab. Dès les années 2010, des études sont arrivées à la conclusion que ce traitement menait à des réponses complètes, notamment chez les jeunes adultes. On sait désormais qu’il apporte un vrai bénéfice lorsqu’il est prescrit avant une allogreffe (greffe avec un donneur).
- Quels nouveaux traitements sont en phase de développement actuellement?
- La recherche fondamentale porte notamment sur le traitement des leucémies aiguës myéloïdes qui présentent de moins bons résultats avec la chimiothérapie. Deux cibles d’immunothérapie ont été mises au jour. L’une, bien validée maintenant, est un anticorps anti-CD33 qui permet, lorsqu’il est couplé à la chimiothérapie, d’améliorer le taux de réponse selon le profil génétique du patient. Plus récemment, la cible CD123 – un récepteur de cellule cancéreuse – a été mise en avant dans un sous-type particulier de leucémies. Nos travaux visent à découvrir de nouvelles cibles immunitaires et de nouveaux moyens d’amplifier la réponse immunitaire dans ces leucémies.
* Anticorps bispécifiques: contrairement aux anticorps monoclonaux, ils ciblent à la fois un antigène tumoral et un antigène du système immunitaire (généralement à la surface des lymphocytes T) afin d’induire une réponse immunitaire antitumorale spécifique.
«Une médecine nouvelle pour la prise en charge des cancers»
Pr George Coukos, chef du département d’oncologie, CHUV-Unil, codirecteur du Swiss Cancer Center Léman

Le Pr George Coukos: «L’un des plus grands défis est l’immunothérapie de deuxième génération.»
Nicolas Righetti / lundi 13
Le Pr George Coukos: «L’un des plus grands défis est l’immunothérapie de deuxième génération.»
Nicolas Righetti / lundi 13- Depuis une dizaine d’années, l’immunothérapie connaît un engouement sans précédent, notamment au sein du département d’oncologie CHUV-Unil et de l’Institut Ludwig Lausanne que vous dirigez. Quelle en est l’actualité aujourd’hui?
- Pr George Coukos: L’un des plus grands défis sur lesquels nous travaillons actuellement est la mise au point d’une immunothérapie de deuxième génération impliquant des lymphocytes T* génétiquement modifiés (appelés Neo-TIL) pour attaquer avec précision la tumeur cible. On parle de thérapie cellulaire. Aujourd’hui, les immunothérapies dont nous disposons fonctionnent très bien pour certains patients mais se heurtent, pour beaucoup d’autres, à des obstacles inhérents à la complexité et à l’ingéniosité des tumeurs.
- Est-ce ce qui explique les différences d’efficacité selon les patients?
- Oui, en grande partie. Les immunothérapies actuelles fonctionnent aujourd’hui bien mieux sur les cancers du sang – lymphomes, leucémie, etc. – que sur les tumeurs «solides» affectant des organes. Les raisons sont en partie physiologiques: les tumeurs présentent des antigènes à leur surface, sortes de «balises» repérées par le système immunitaire. Ce phénomène est à la base de l’immunothérapie. Or sur les tumeurs solides, ces «balises» exclusives sont moins évidentes que dans les cancers du sang. D’où l’idée d’utiliser d’autres éléments propres à la tumeur (des mutations) pour concevoir des «radars» spécifiques et sans danger et en équiper les lymphocytes T: ce sont les Neo-TIL.
- Comment voyez-vous la suite?
- Pour ces immunothérapies de deuxième génération, nous espérons des résultats à l’horizon 2022-2023. Plus globalement, je suis convaincu que l’immunothérapie par lymphocytes T n’en est qu’à ses débuts et va ouvrir la voie à une médecine nouvelle pour la prise en charge des cancers, mais également de l’ensemble des maladies immunologiques.
* Lymphocytes: cellules du système immunitaire, responsables des réactions de défense de l’organisme contre les agents pathogènes qu’elles considèrent comme dangereux. Les lymphocytes T constituent environ 80% des lymphocytes de l’organisme et ont la capacité de se multiplier rapidement pour cibler les antigènes. Les lymphocytes B produisent quant à eux des anticorps pour agir contre un antigène déterminé.
«Aujourd’hui, seule une minorité de patients répond au traitement»
Pr Mikaël Pittet, professeur au département de pathologie et immunologie de l’Unige, titulaire de la chaire Fondation ISREC en immuno-oncologie et membre de l’Institut Ludwig Lausanne

Le Pr Mikaël Pittet: «Pouvons-nous découvrir pourquoi certains patients bénéficient de l’immunothérapie et d’autres pas?»
Julie de Tribolet
Le Pr Mikaël Pittet: «Pouvons-nous découvrir pourquoi certains patients bénéficient de l’immunothérapie et d’autres pas?»
Julie de Tribolet- Certaines de nos cellules immunitaires sont-elles de meilleurs «soldats» que d’autres?
- Pr Mikaël Pittet: En effet, les tumeurs peuvent être infiltrées par différentes cellules immunitaires. Il est donc important de définir lesquelles sont les plus importantes, puis de les mobiliser grâce à l’immunothérapie. Ces dernières années, la recherche s’est portée sur les lymphocytes T. Deux approches ont été développées. La première utilise des inhibiteurs de checkpoints immunitaires qui permettent d’activer les lymphocytes T, qui peuvent alors attaquer les cellules cancéreuses. La seconde, plus personnalisée, consiste à prélever un échantillon de tumeur pour en extraire les lymphocytes T, puis à multiplier et à renforcer ces cellules avant de les réinjecter au patient.
- L’immunothérapie ne constitue pas pour autant une arme infaillible?
- Aujourd’hui, l’immunothérapie peut produire des résultats cliniques exceptionnels, comme le contrôle durable de certains cancers avancés, mais seule une minorité de patients répond au traitement. Il en découle plusieurs questions majeures: pouvons-nous découvrir pourquoi certains patients bénéficient de l’immunothérapie et d’autres pas? Pouvons-nous trouver des façons plus efficaces pour stimuler le système immunitaire contre le cancer? Les réponses à ces questions sont importantes car elles sont susceptibles de définir les immunothérapies de demain.
- Quels sont les autres axes de recherche à suivre?
- L’un des grands domaines qu’il nous reste à explorer est la variété de cellules immunitaires. On connaît bien les lymphocytes T, mais il en existe d’autres qui semblent intéressantes, comme les cellules myéloïdes. On comprend peu à peu leurs particularités et leurs mécanismes d’action, et cela ouvre à de potentielles nouvelles stratégies thérapeutiques, notamment chez les patients qu’on ne parvient pas à traiter avec l’immunothérapie existante.
«Vaccin anti-cancer: des résultats encourageants»
Pr Nicolas Mach, médecin responsable de l’unité de recherche clinique du service d’oncologie des HUG

Le Pr Nicolas Mach: «Notre stratégie personnalisée est une vaccination thérapeutique, c’est-à-dire qui vise à soigner la maladie et non pas à l’éviter.»
Julie de Tribolet
Le Pr Nicolas Mach: «Notre stratégie personnalisée est une vaccination thérapeutique, c’est-à-dire qui vise à soigner la maladie et non pas à l’éviter.»
Julie de Tribolet- Comment fonctionne le vaccin anticancéreux?
- Pr Nicolas Mach: De nombreux groupes de recherche ont développé différentes méthodes pour renforcer les défenses immunitaires contre le cancer. Notre stratégie personnalisée est une vaccination thérapeutique, c’est-à-dire qui vise à soigner la maladie et non pas à l’éviter. Cette approche «sur mesure» consiste à éduquer le système immunitaire pour l’aider à lutter contre les cibles propres à chaque tumeur. Il faut savoir qu’une cellule tumorale est à 99,9% identique à une cellule saine et il est donc très difficile pour le système immunitaire de la distinguer. La réalisation de notre vaccin anticancéreux nécessite de prélever un morceau de métastase sur le patient puis d’en inactiver les cellules en laboratoire. L’étape suivante consiste à réinjecter ces quelques millions de cellules dans l’organisme, pour fournir aux défenses immunitaires un répertoire de cibles complet et les aider à mieux les reconnaître. En parallèle, le système immunitaire est renforcé grâce à un activateur puissant, introduit sous la peau dans une petite capsule qui stimule tant les lymphocytes que les anticorps.
- Où en êtes-vous dans son développement expérimental?
- Nous sommes actuellement dans la phase 2, c’est-à-dire l’évaluation de l’efficacité dans le cadre d’un protocole d’étude clinique. La phase 1 nous a permis d’obtenir des résultats satisfaisants en termes de faisabilité et de sécurité, sans aucun effet secondaire sévère. Une activité antitumorale sous la forme de réponses clinique, radiologique et/ou biologique (stimulation des lymphocytes spécifiques) a été observée dans plusieurs types de cancers. Nous menons désormais nos essais sur une quarantaine de patients atteints de cancers ORL avancés, en rechute après une chimiothérapie et une immunothérapie «classique». Le premier objectif chez ces patients avec une maladie métastatique en rechute après les traitements traditionnels est de parvenir à 50% de patients en vie à six mois. Les résultats encore préliminaires sont encourageants, mais il faut être prudent car il s’agit d’un petit nombre de patients, et il reste encore plusieurs étapes à parcourir avant de pouvoir mettre un vaccin anti-cancer sur le marché.
- Ce vaccin pourrait-il être proposé quel que soit le cancer?
- La particularité de ce traitement sur mesure – dont une partie provient du patient lui-même – est qu’il est potentiellement utilisable pour tous les types de cancers, quel que soit le stade de la maladie. Des études préliminaires sur les souris montrent une efficacité de ce type de vaccination sur de multiples tumeurs telles que celles affectant poumon, prostate, cerveau, sein, côlon ou encore les leucémies.